近日,吉林大学物理学院付作岭教授课题组在稀土掺杂锂基氟化物纳米荧光探针的研究中取得重要进展。通过巧妙的核壳结构设计,成功实现了近红外成像指导下的药物释放过程温度可视化。这一成果为药物释放的精准控制和实时监测提供了新的技术手段。相关成果以“Li-Based Nanoprobes with Boosted Photoluminescence for Temperature Visualization in NIR Imaging-Guided Drug Release”为题发表在国际学术期刊《Nano Letters》上。

稀土掺杂氟化物纳米材料凭借其卓越的光学性能、良好的生物相容性、灵活的核壳结构设计以及多功能特性,在生物医学研究领域引发了广泛关注,为疾病的诊断与癌症的治疗提供了创新的解决方案。其中,光动力疗法(PDT)作为一种微创治疗手段,通过光、光敏剂与活性氧(ROS)的相互作用,诱导局部细胞损伤,已逐渐成为主流的治疗选择。在此过程中,温度作为一个至关重要且往往被忽视的因素,对ROS的生成速率、动态平衡以及细胞间的协同作用均产生显著影响。因此,在ROS释放过程中,精确监测并控制局部温度对于最大化治疗效果、同时最小化潜在损害具有至关重要的意义。
然而,传统的接触式温度计因空间分辨率有限且具有组织侵入性,难以满足当前的研究需求。非接触式红外热成像技术虽然能与光学显微镜结合使用,但在检测组织或物体内部温度时仍存在诸多局限。为应对这些挑战,发光纳米温度计作为一种尖端工具,在远程活体热成像领域中脱颖而出。它利用对温度敏感的发光特性,实现了精确、非侵入性且远程的纳米级温度测量。
在本项研究中,付作岭教授团队成功研发了一种高效的锂基核-壳-壳(CSS)结构纳米探针。该探针具有独特的三层结构,包括菱形活性核、菱形活性壳和球形惰性保护壳。通过引入Yb3+离子作为能量转移桥,并优化CSS设计,与原始LiYF4: 10%Nd3+, 2%Ho3+纳米颗粒相比,可见光区域的发射强度增强了1643倍,近红外区域(NIR)的发射强度提高了33倍。同时,系统比较了锂基纳米颗粒与传统钠基纳米颗粒的光致发光强度、量子产率和亮度,结果显示锂基体系具有显著优势,这与有限差分时域(FDTD)模拟中获得的光场吸收结果一致。随后,CSS-PEI纳米颗粒成功与玫瑰红己酸(RBHA)结合,并通过808 nm激光照射下的ROS生成实验,验证了其高效的上转换激活药物释放性能。此外,利用Yb3+离子在1005 nm处的温敏发射寿命,实现了药物释放过程中的实时温度传感和NIR成像,推进了非侵入性临床诊断和靶向癌症疗法的发展。
吉林大学物理学院博士研究生李柯洁为本文的第一作者,本文通讯作者为吉林大学物理学院付作岭教授,哈尔滨工业大学陈冠英教授,郑州大学贾陌尘副教授。该工作得到了国家自然科学基金以及吉林省科技发展计划重点研发项目的资助,同时也得到了吉林大学物理学院仪器共享平台的大力支持。
论文全文链接:
https://pubs.acs.org/doi/10.1021/acs.nanolett.4c05153
图文导读:
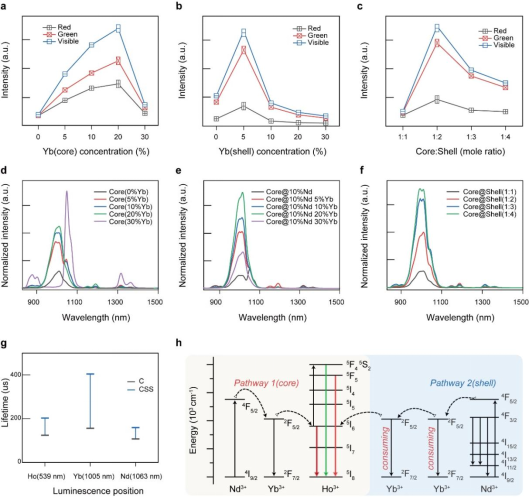
图1. (a-c) 可见光区域发光增强;(d-f) NIR区域发光增强;(g)荧光寿命变化图;(h) CSS NPs中的能量转移机制和发光增强机理图。
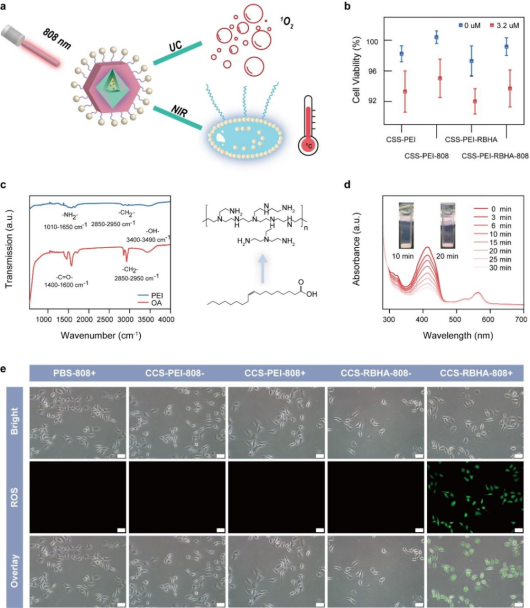
图4.(a) ROS生成过程中温度监测示意图;(b) 细胞活性;(c) OA修饰和PEI修饰CSS NPs的FT-IR光谱;(d) 808 nm照射不同时间的吸收光谱;(e) 不同条件下ROS的生成检测。
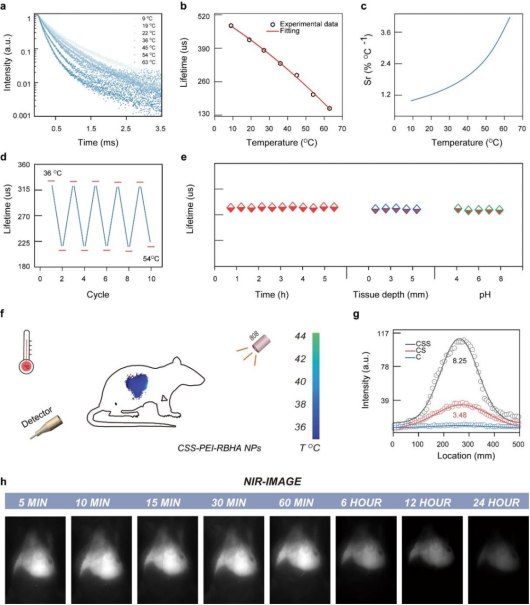
图5. (a) 温度依赖的荧光寿命;(b) 寿命与温度的校准曲线;(c) 相对灵敏度;(d)加热-冷却循环中的寿命;(e)连续激光照射、不同pH和组织穿透深度下的寿命;(f) 注射CSS-PEI-RBHA NPs后活体小鼠肝脏的温度成像;(g) NIR成像信噪比;(h) 使用CSS-PEI-RBHA NPs的活体实时NIR成像。